Применение нашатырного спирта в домашней медицине
Нашатырный спирт нашел широкое применение в домашней терапии, поэтому необходимо иметь раствор нашатыря в своей домашней аптечке:
- Лучшее средство от обмороков и потери сознания. Чтобы привести человека в чувство, достаточно протереть спиртом виски и поднести ватку с нашатырем к носу. Резкий, едкий запах раздражая слизистую носа, быстро выведет человека из обморока.
- Поможет нашатырь при алкогольном отравлении и при похмелье. Чтобы пьяного привести в чувство, нужно дать ему подышать парами нашатырного спирта. Если это не помогло, или помогло слабо, нужно дать выпить пациенту раствор воды, содержащий нашатырный спирт.
- При слабом отравлении алкоголем — 2-3 капли на стакан воды.
- При среднем отравлении — 4-6 капель на стакан воды.
- При сильной интоксикации -7-10 капель на стакан воды.
При этом необходимо сильно растирать нашатырем виски и мочки ушей в течении 1 — 15 минут.
Нашатырь поможет снять сильную головную боль. Одной из двухсот причин вызывающих ее являются бляшки в сосудах головы. Преодолеть боль от них поможет компресс из нашатырного спирта. В стакан воды добавить столовую ложку 10% нашатыря, смочить им чистую, хлопчатобумажную ткань и положить повязку на лоб на полчаса. Лечение применяют при внезапно возникшей головной боли. В качестве профилактики, процедуру проводить 7-10 дней. Три дня перерыв и еще 10 дней.
Нашатырный спирт применяют и при лечении больных суставов рук и ног. Делают примочку(компресс),состоящий из стакана водки, одной ст. ложки с горкой соли и нескольких капель нашатырного спирта. Хорошенько обматывают стрейч пленкой и укутывают сверху теплым платком. Компресс оставляют на несколько часов, или проводят с ним ночь. Примочку применяют 7-10 дней, в зависимости от состояния суставов
Если приложить к месту, укушенному осой, пчелой, комаром, или другим насекомым раствор аммиака, то зуд и боль быстро пройдут. Амиак (нашатырный спирт) + вода, жидкости нужно смешать между собой в одинаковых пропорциях и нанести на место укуса ватной палочкой.
Вот почему нашатырь всегда должен присутствовать в вашей домашней аптечке.

Основные понятия о соединении
О том, что представляет собой рассматриваемая химическая связь, можно понять уже по одной только структурной формуле хлорида аммония — NH4CL, притом что это вещество реально получить не только посредством искусственного синтезирования, но и в природной среде, в которой он представляется в виде минерального нашатыря. При нормальном температурном режиме являет собой белые кристаллы без запаха и присутствия соли.
Физические свойства NH4CL
Объем одной кубической сингонии хлористого аммония, под которой подразумевается элементарная ячейка кристалла, определяется по актуальной для простейшего геометрического куба формуле, где a возводится в третью степень. Чтобы вычислить эту величину рассматриваемого соединения, достаточно просто знать, чему равно a, которое является константой, соответствуя 0,38758 нанометра при z=1. Что касается остальных физических свойств и параметров, то среди ключевых из них стоит выделить:

- Показатель относительной плотности взаимодействия азота, водорода и хлора, дающего хлорид аммония, равен 1,526 кг на метр кубический.
- Молярная масса хлорида аммония соответствует 53,5 грамма на моль.
- Сохранение структуры кубической кристаллизации наблюдается при любых температурах до отметки в плюс 184,3 градуса Цельсия. При дальнейшем нагревании имеет свойство быстро улетучиваться. К примеру, уже после достижения столбика термометра 337, 6 градуса вещество моментально возгоняется, переходя из твердого состояния в летучий газ даже без промежуточного преобразования в жидкий раствор. При этом связь не остается в исходном виде, так как высокие температуры приводят к разложению хлорида аммония на такие вещества, имеющие высокий класс опасности, как чистый аммиак и соляная кислота.
- При замерзании образует ионную кристаллическую решетку. Что касается температурного режима, при котором происходят подобные изменения, то обычно все зависит от концентрации раствора и, к примеру, 10-процентная жидкость кристаллизуется уже при минус 6,95 градусах Цельсия.
Среди прочих особенностей NH4CL стоит выделить его высокую степень растворимости как в холодной, так и в горячей воде. К примеру, при нулевой температуре жидкости в ее 100 граммах растворяется 29,4 грамма вещества, тогда как в кипятке расходится уже 77,3 грамма. Стоит отметить, что, помимо обычной воды, соединение легко растворяется в жидком аммиаке, а также в безводных растворителях, но только при условии использования связи в порошкообразном виде, а не в концентрированном водном растворе.
В этом случае в 100 граммах этанола удастся растворить до 0,6 грамма кристаллов, а в метаноле до 3,3 грамма. Если же использовать водные растворы, то в процессе гидролиза, подразумевающего собой сольволиз водой, в них будет неизменно наблюдаться слабокислая реакция.
Химические особенности связи
Вещество имеет множество химических особенностей, среди которых — вступление в реакцию со щелочными соединениями. К примеру, с тем же нитритом натрия хлористый аммоний начинает реагировать при достижении 100-градусной температуры, образуя не только воду и азот, но и новое соединение хлорида и натрия. Среди прочих свойств связи стоит необходимо обозначить:
- Если пропустить через соединение разряд электрического тока, то произойдет его разложение с дальнейшим преобразованием в хлористый азот (NCL3).
-
Гидролиз хлорида аммония происходит только по катиону при устойчивом поддержании кислой среды. В этом случае актуальным будет следующее уравнение: NH4Cl + H2O NH4OH +HCl.
- Для получения чистого аммиака специалисты прибегают к нагреванию соединения вместе со щелочами. В качестве наглядного примера можно привести такое щелочное соединение, как гидроксид натрия, которое в случае взаимодействия с NH4CL распадается на воду, хлорид натрия и аммиак.

Влияние на человека
 При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку
При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку
и придерживаться правил пользования.
При намерении использовать аммиак приобретать его надо исключительно в аптеках и внимательно знакомиться с прилагаемыми правилами пользования «Раствор аммиака. Инструкция по применению».
Превышение дозировок может вызвать отравление и серьезные проблемы со здоровьем, а также химические ожоги. Помещения, где он применяется, должны хорошо проветриваться.
Кроме ядовитости, пары аммиака взрывоопасные. Это происходит при смешении их с воздухом в определенной пропорции, поэтому при работе необходимо соблюдать особые правила техники безопасности при работе со взрывчатыми веществами.
Первыми симптомами отравления могут быть:
- появление красных пятен на лице и теле;
- учащенное дыхание;
- общая возбужденность.
Дальнейшими признаками развития отравления являются:
- появление острой боли за грудиной;
- судороги;
- отек гортани;
- спазм голосовых связок;
- мышечная слабость;
- нарушение кровообращения;
- полуобморочное состояние, вплоть до потери сознания.
При приеме внутрь аммиачной воды в превышающих дозах может возникнуть:
- понос с ложными болезненными позывами;ожог пищевода, желудка и начальных отделов кишечника;
- кашель, слезотечение, слюнотечение и чих;
- остановка дыхания рефлекторного характера;
- рвота с запахом аммиака;
- прием аммиачного спирта в количестве от 10 до 15 гр. грозит летальным исходом.
Если у человека имеется индивидуальная непереносимость к запаху аммиака, то даже незначительное его попадание через дыхательные пути или вовнутрь может сразу привести к самым неблагоприятным последствиям.
Первая помощь при отравлении
В случаях возникновения первых признаков отравления этими веществами необходимо срочно начать оказывать пострадавшему первую помощь.
К первой помощи можно отнести следующие меры:
В случае более тяжелых форм отравления необходимо срочно вызывать скорую помощь.
Аммиачный спирт обязателен в наборах медикаментов для первой помощи в аптечках и в нужный момент должен быть под рукой.
Сколько может стоить в аптеках? Ответ — совсем недорого. Приобретайте, пользуйтесь, но будьте предельно осторожны.
Внимание, только СЕГОДНЯ!
Латинское название:
Solutio AmmoniicausticiКод АТХ:
V03AXДействующее вещество:
АммиакПроизводитель:
Тверская фармацевтическая фабрика, РоссияУсловие отпуска из аптеки:
Без рецепта
Нашатырный спирт – это раствор аммиака, бесцветная жидкость, выпускается в концентрации 10%. Обычно его применяют для отрезвления при алкогольном отравлении в медицине или для того, чтобы привести быстро в чувство упавшего в обморок человека. Химическая формула – NH4OH. Раствор аммиака тоже называется гидроксид аммония. Также следует различать, что аммиак – это газ с резким запахом, который легко трансформируется в жидкую форму. Нашатырь от нашатырного спирта отличается своим составом. Если нашатырь это соли аммония, то нашатырний спирт является аммиаком. Формула нашатыря – NH4Cl. В медицине нашатырь не используется, так как опасен, его используют в технических целях.
Что такое хлорид аммония
Первенство в получении вещества принадлежит древним египтянам и грекам. Название происходит от египетского слова «Аммоний». Так называли божество, в храме которого вдыхали испарения «нушадира» – раствора, сделанного из порошка с пещерных стен. С годами слово стало звучать как «нашатырь». Ammonium chloride, или хлорид аммония – это соль аммония. Выглядит как сухой кристаллический порошок без запаха, слегка солоноватый, белого цвета.
Хлорид аммония – формула
Структурная формула хлорида аммония – NH4Cl, по строению вещество представляет собой химическое соединение аммония с хлором. Лабораторный метод получения реагента выглядит как процесс упаривания маточного раствора хлорной извести. Второй способ – реакция взаимодействия между хлором и аммиаком. Народные умельцы придумали, как получить вещество из солевых батареек путем очищения и выпаривания.

Хлористый аммоний – свойства
Вскоре после открытия порошка ученые выделили свойства хлорида аммония:
- гигроскопичность, или способность собирать воду;
- растворение в воде, жидком аммиаке, метиловом и этиловом спирте с небольшим осадком;
- способность реагировать на щелочи;
- летучесть при возгорании: образуется белый плотный дым и пары аммиака;
- полное разложение под действием электрического разряда и температуре больше 338 градусов Цельсия.
Для получения нашатырного спирта сухой реактив смешивается с водой. В отличие от исходного соединения у него другая формула и свойства. Водный раствор обладает резким запахом. Чрезмерное вдыхание приводит к передозировке и летальному исходу. Врачи советуют хранить нашатырь отдельно от других лекарств
Пользоваться веществом нужно с особой осторожностью, ограничивая вдыхание несколькими секундами. Признаки передозировки хлористым аммонием и его производными:
- тошнота;
- учащенное дыхание;
- потеря аппетита;
- рвота.
Аналоги
 Омская фармфабрика, Россия
Омская фармфабрика, Россия
Цена
– 20 рублей за флакон.
Действующее вещество – муравьиная кислота в 70% растворе этанола. Препарат обладает раздражающими и антисептическими свойствами. Используется для стерильной обработки открытых ран, мест для инъекций. Также наносится на больные участки тела при миалгии и неврите.
Плюсы:
- Недорогой
- Проверенное и эффективное средство
- Быстрое действие.
Минусы:
- Нельзя принимать перорально
- Возможны ожоги кожи при слишком частом нанесении.
Кордиамин
 Вектор-фарм, Россия
Вектор-фарм, Россия
Цена
– 250 рублей за упаковку.
Действующее вещество – никетамид. Выпускается в инъекционной форме. Является аналептическим средством, которое оказывает возбуждающее действие на нервную систему. Используется для ослабления дыхательных функций у больных с инфекциями, а также для устранения удушья новорожденных, коллапса и обморочных состояний.
Плюсы:
- Сильное, действенное средство
- Имеет немного побочных явлений
- Быстро оказывает терапевтический эффект на организм.
Минусы:
- Дорогой
- Нет пероральной формы для применения.
приложений
1- Медицина
Хлорид аммония выполняет очень важную биохимическую функцию: он поддерживает физиологический уровень pH.
Как кислотная соль, она может помочь исправить ситуации, в которых концентрация хлорид-ионов в плазме низкая или в случаях алкалоза крови (высокий уровень pH крови). Это может произойти после рвоты, всасывания (удаления) содержимого желудка, использования диуретиков (таблеток с водой или жидкостью) или при некоторых заболеваниях желудка..
Хлорид аммония также вызывает выведение излишков солей и воды через мочеиспускание и вызывает ацидоз в моче (делает его более кислым).
Хлорид аммония также используется для уменьшения отека или увеличения веса, которое происходит до менструации, и в качестве помощи при лечении инфекций мочевыводящих путей (Университет Юты, 2017).
Это компонент многих лекарств от простуды и кашля из-за его эффективности в качестве отхаркивающего средства. В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец (Encyclopædia Britannica, 2016).
2- Удобрения
Хлорид аммония в основном используется в качестве источника азота в удобрениях (что соответствует 90% мирового производства соединения), таких как хлораммонийфосфат, в основном для выращивания риса и пшеницы в Азии..
3- Металлургия
Хлорид аммония используется в качестве флюса при изготовлении металлов, которые должны быть покрыты оловом, оцинкованы или сварены. Он работает как флюс, очищая поверхность заготовок, реагируя с оксидами металлов на поверхности, образуя летучий хлорид металла..
Для этого он продается в блоках в хозяйственных магазинах для использования при чистке наконечника паяльника и может быть включен в припой в виде флюса..
4- компонент батареи
Хлорид аммония, NH4Cl, является компонентом сухих батарей, энергетических резервуаров, которые питают электрические устройства. Батареи позволяют вам использовать электричество, когда вы не находитесь рядом с электрической розеткой или розеткой.
Для каждой батареи есть три основных компонента: катод (верхняя часть вашей обычной батарейки АА, из которой текут электроны), анод (нижняя часть батареи АА, в которую текут электроны) и электролит для через которые могут двигаться электроны и ионы.
Когда хлорид аммония используется в качестве электролита в батарее, он превращается в водную пасту и помещается между катодом и анодом.
Химические реакции между катодами батареи и анодами заставляют электроны протекать через пасту из хлорида аммония от катода к аноду.
Электроны проходят через металлические контакты в батарейном отсеке, заставляя электрическое оборудование работать (American Chemistry Council, Inc., 2005).
5- Еда
В некоторых странах хлорид аммония, под названием соль аммиака или разговорно сальмиакки, используется в качестве пищевой добавки под номером E E510, обычно в качестве дрожжевого питательного вещества при производстве хлеба.
Это пищевая добавка для крупного рогатого скота и ингредиент в питательной среде для дрожжей и многих микроорганизмов.
Хлорид аммония используется для придания вкуса темным конфетам, называемым соленой солодкой (очень популярным в скандинавских странах), для выпечки, чтобы дать бисквитам очень хрустящую текстуру, а в ликере Salmiakki Koskenkorva для ароматизации..
В Индии и Пакистане его называют «ношадер» и используют для улучшения свежести бутербродов, таких как самоса и джалеби.
6- Другое использование
Хлорид аммония можно найти в шампунях, красках и отбеливателях для волос, средствах для мытья и очищения тела, моющих средствах для лица, кондиционере, моющем средстве для мытья посуды, а также в маслах и солях для ванн..
Хлорид аммония также используется в травлении при изготовлении печатных плат, таких как огнетушитель. Он также является компонентом фейерверков, взрывчатых веществ и спичек, а также отвердителем в клеях на основе формальдегида..
Зачем и как добавлять нашатырь или другие азотистые вещества в домашнее вино
Для нормального размножения и жизнедеятельности винных дрожжей требуется сахар, минеральные и азотистые вещества. Зачастую ягодные и фруктовые соки содержат достаточное количество требуемых дрожжам питательных элементов. Проблемы начинаются, когда для снижения кислотности сусло сильно разбавляют водой и (или) вносят много сахара. В итоге концентрация азотистых веществ падает.
Первые несколько дней брожение идет активно, но потом процесс замедляется без видимых причин (сахара достаточно, температура подходящая, концентрация спирта не достигла предела). При нехватке азота вино бродит дольше обычного, но не набирает крепости выше 8-9%, часть сахара остается несброженной. Если в такое сусло правильно внести азотистые соединения (аммиак, нашатырь или нашатырный спирт), то брожение возобновляется до нормальной интенсивности.
Почти все магазинные винные дрожжи поставляются вместе с разработанной под конкретный штамм дрожжевых грибков подкормкой, поэтому дополнительная может быть даже вредной. Подкармливать домашние вина азотистыми соединениями целесообразно только в случае использования самодельной закваски или диких винных дрожжей, которые живут на поверхности плодов.
Физико-химические свойства
Хлорид аммония — это гигроскопичные мелкодисперсные белые частицы без запаха (Национальный центр биотехнологической информации, 2017).

Соединение имеет триклинную сетчатую структуру с кубической структурой с центром в центре. Его молекулярная масса составляет 53 490 г / моль, его плотность составляет 1,5274 г / мл, а температуры плавления и кипения составляют 338 ° С и 520 ° С..
Хлорид аммония растворим в воде, способен растворять 383,0 г соединения на литр растворителя. Он также растворим в этаноле, метаноле и глицерине и мало растворим в ацетоне. Он нерастворим в органических растворителях, таких как этилацетат (Royal Society of Chemistry, 2015).
Хлорид аммония может подвергаться различным реакциям, имеющим большое значение для химической и фармацевтической промышленности. Может разлагаться при нагревании в соляной кислоте и аммиаке:
Нью-Гемпшир4Cl → NH3 + HCl
Кроме того, он может реагировать с основаниями, такими как гидроксид натрия или калия, с образованием газообразного аммиака:
Нью-Гемпшир4Cl + NaOH → NH3 + NaCl + H2О
Другая важная реакция, в которой используется хлористый аммиак, — это разложение карбонатов и бикарбонатов с образованием соли и аммиака:
2NH4Cl + Na2Колорадо3 → 2NaCl + CO2 + H2O + 2NH3
Хлорид аммония считается кислой солью. Полученные растворы содержат умеренные концентрации ионов гидрония и имеют рН менее 7,0. Реагируют как кислоты, чтобы нейтрализовать основания.
Как правило, они не реагируют как окислители или восстановители, но такое поведение не является невозможным. Многие из этих соединений катализируют органические реакции (хлорид аммония, 2016 г.).
Применение нашатырного спирта в косметологии
Средства для обесцвечивания и окраски волос
Самое известное средство для модниц это использование аммиака содержащих средств для обесцвечивания и окраски волос. Многие краски для волос имеют в своем составе аммиак. Он помогает раскрыть чешуйки на волосках и обладает осветляющим эффектом. Женщины, хоть раз в жизни красившие волосы знакомы с его запахом и действием.
Современные краски для волос делают уже без применения аммиака. Они имеют в своем составе этаноламин и стоят значительно дороже. Применяются в парикмахерских, как профессиональные средства для окраски волос. В быту многие женщины предпочитают известные и опробованные аммиачные краски для волос.
После применения такой краски, требуется защитная пленка для волос. Закрыть чешуйки на волосах поможет косметика содержащая силикон и полимеры. Иначе волосы потеряют внутреннюю влагу, станут сухими и ломкими.
Раствор нашатырного спирта применяют для очищения кожи на руках и на лице. С его помощью можно осветлить пигментные пятна

Средства от трещин, огрубелостей, натоптышей и мозолей на основе нашатыря.
Грубую и шершавую кожу на ступнях, локтях и коленках, делает мягкой и гладкой средство на основе нашатырного спирта. Крем из глицерина и нашатыря, смешанный в пропорциях 50/50, втирают в чистую кожу проблемных частей.
Процедуру проводят каждый вечер, перед сном, в течении недели. Через семь дней, вы не узнаете проблемные участки вашей кожи. Такой гладкой и шелковистой коже позавидует и младенец. Исчезнут натоптыши, пропадут трещины, образуется бархатистая гладкость.

Лечения с помощью нашатыря грибка ног и ногтей
Несоблюдение гигиены дома, и в общественных местах (банях, бассейнах, парикмахерских, спортзалах, поликлиниках и др.) может привести к заболеванию грибком. Особенно ему подвержены стопы, ладони и ногти. Нашатырный спирт и здесь придет помощь и поможет в лечении, особенно на первых стадиях заболевания.
Появлению грибка может произойти вследствие ослабления иммунитета. Заболевания, например сахарным диабетом. Тесной обуви, особенно если она выполнена из некачественных материалов. Травм рук и ног. Длительного приема лекарств, особенно антибиотиков.
Так как нашатырь это щелочь, он оказывает пагубное влияние на все типы грибков. Убивает их, разрушая наружные клеточные ткани и проникает внутрь. Из нашатыря делают мази, ванночки, компрессы.
Если поражение ногтя грибком обширно, то применяют комплексную терапию. Нашатырным спиртом размягчают, подсушивают и открывают поры на ногте. А противогрибковыми средствами, уничтожают грибок изнутри.
Рецепт компресса против грибка ногтя из нашатыря:
В стакане воды растворить одну столовую ложку нашатырного спирта. Смочить в этом растворе ватный диск, или тампон. Наложить его на пораженный ноготь и сверху закрыть пленкой, или одеть на палец напальчник.
Усилить эффект воздействия, поможет тепло. Поэтому сверху надеваем теплый носок. Компресс делаем вечером и оставляем до утра. Курс длится 10 дней, затем делаем перерыв на 4 дня и при необходимости процесс повторяем.
Для лечения грибка стопы и застарелого грибка ногтя применяют ванночки. На одну часть 10% нашатырного спирта, берут одну часть перекиси водорода и две части теплой воды. Опускаем в раствор чисто вымытые ноги на 15 минут. Насухо вытираем и наносим на проблемные участки ногтя противогрибковое средство. Курс длиться от 7, до 10 дней.

Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
- металлургия – травление металлов;
- деревообработка – защита древесины от вредителей;
- медицина – производство лекарств;
- пищепром – приправа;
- химическая промышленность – реагент для опытов;
- радиотехника – удаление оксидной пленки в процессе пайке;
- машиностроение – устранение загрязнений с поверхности;
- пиротехника – дымообразователь;
- гальваника – электролиты;
- сельскохозяйственные работы – азотное удобрение;
- фотодело – фиксаж для снимков.
В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
- При обмороке нашатырь оказывает возбуждающее действие на человека, приводит в сознание.
- При отеках ценится действие диуретиков или мочегонных веществ, выводящих лишнюю жидкость.
- При пневмонии, хроническом бронхите и бронхиальной астме помогает от сильного кашля.
На втором месте находится пищевая промышленность. Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин. В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц. Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла. Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.

Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях. Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов. Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
Медицинские средства, используемые в быту
Нашатырный спирт и аммиак не единственные медицинские средства, которые можно использовать для хозяйственных целей. В быту хозяйками часто применяется хлорид аммония и перекись водорода.
Не все из указанных выше средств можно приобрести в аптечных пунктах. Например, нашатырь и аммиак продается только в специализированных магазинах или отделах бытовой химии. Следует заметить, что состав, а также процесс получения этих препаратов отличается друг от друга
Это можно увидеть, обратив внимание на формулу
каждого вещества
Разберемся с химическими формулами
Люди, не разбирающиеся в химии, считают, что нашатырный спирт, нашатырь, аммиак и перекись водорода – это похожие по своему составу вещества. На самом деле все не совсем так. Конечно, некоторые из препаратов имеют одинаковый запах, но они отличаются химической формулой, а также способом получения.
Что касается нашатыря, то его внешний вид напоминает порошок белого цвета. Нашатырный спирт имеет внешнее сходство лишь с перекисью водорода. Хотя по своему составу они также отличаются.
Формула аммиака
Аммиак – это бесцветный газ, имеющий резкий запах. Химически, подобное вещество записывается следующей формулой: NH 3 . Температура плавления газа составляет -77,73 градуса по Цельсию. Что касается температуры кипения, то она равна -33,34 градуса по Цельсию.
Для получения аммиака промышленным способом, специалисты объединяют водород с азотом. Это можно записать следующей формулой: 3H 2 +N 2 =2NH 3 .
В лабораторных условиях используется аммоний, на который воздействуют сильные щелочи.
Нашатырный спирт и его формула
В отличие от аммиака, нашатырный спирт является бесцветной жидкостью, имеющей резкий запах. Это вещество имеет следующую химическую формулу: NH 4 OH. Иногда можно встретить и другую формулу: NH 3 ∙H 2 O. Подобная запись используется для 10% водного раствора аммиака.
У многих людей возникает вопрос, почему водный аммиачный раствор получил название спирта. Все просто, с латинского языка слово «spiritus» означает испарение. Это же касается и нашатырного спирта. Если емкость оставить открытой, вещество быстро испарится.
Формула нашатыря
Хлорид аммония получают природным и химическим путем. Его формула записывается следующим образом: NH 4 Cl.
В природе вещество можно встретить внутри трещин земной коры и рядом с вулканами. Обычно хлорид аммония похож на белый налет.
Формула перекиси водорода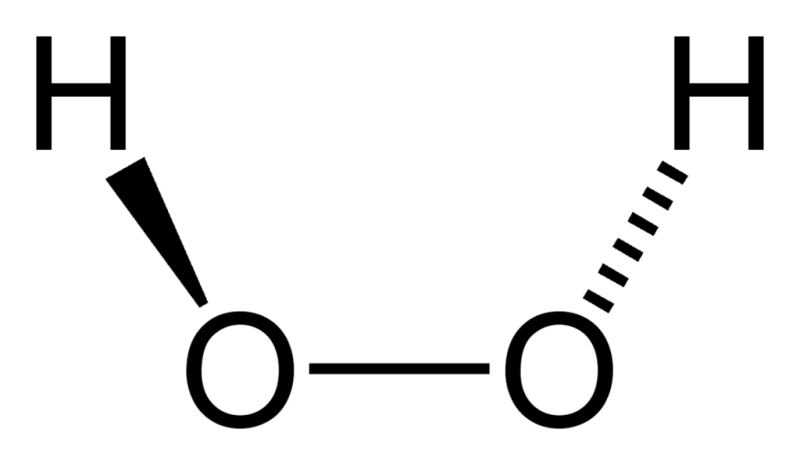
Нет такого человека, которому бы не приходилось сталкиваться с перекисью водорода. Внешне, вещество напоминает бесцветную вязкую жидкость. При больших объемах средство принимает синеватый оттенок. К тому же вещество не имеет запаха и вкуса. Что касается химической формулы, то она записывается следующим образом: H 2 O 2 .
Пероксид водорода закипает при температуре 150,2 градуса по Цельсию.
Аммиак в промышленности
Амонова соль — аммиак по-гречески, газ с резким запахом не имеющий цвета. С температурой плавления менее 80 и температурой кипения 35 градусов Цельсия. Газ хорошо растворимый в спирте, воде и других жидкостях. В промышленности аммиак получают из водорода и азота. В природе образуется при разложении органических и азотосодержащих соединений.
Чистый аммиак впервые был синтезирован в 1774 году английским химиком Дж. Пристли. Промышленный способ получения аммиака, произвели в 1913 году немецкие химики Ф. Габер и К. Бош. За эти разработки они стали лауреатами Нобелевской премии.
Сегодня аммиак один из самых ценных и востребованных продуктов в химической промышленности. Из него получают азотную кислоту, делают красители и азотные удобрения. Используют при производстве взрывчатых веществ и пищевой соды. Широко применяют аммиак, для изготовления водных растворов. 10% раствор аммиака получил название нашатырный спирт.
Нашатырь — хлорид аммония используют при пайке металлов. Разлагаясь при высокой температуре, выделяется аммиак. Он очищает поверхность спаиваемого металла и паяльника от образующихся оксидов, окалины и нагара.
Испаряющийся аммиак поглощает огромное количество теплоты. Эту особенность используют в холодильниках, морозильных камерах и кондиционерах. Аммиак используют даже в космосе. Он применяется для охлаждения контуров энергоснабжения международной космической станции.